Il ruolo dell’interferone nella risposta immunitaria
Nell’ultimo blog abbiamo parlato delle soluzioni terapeutiche emergenti per il controllo dell’iper-infiammazione nella HLH e abbiamo visto come esse agiscano sui meccanismi intracellulari che coinvolgono le trascrizioni di geni infiammatori delle citochine innescate dal legame dell’interferone gamma (INF-γ) con il suo recettore.
Il legame recettore-INF-γ è quindi cruciale nell’attivazione di una corretta risposta immunitaria contro le infezioni virali. Due altri tipi di interferone, l’IFNα e il IFNβ, collaborano con INF-γ nella azione di controllo contro i virus.
Infatti il paradigma immunitario attuale, sostiene che il rilevamento di virus nel corpo umano è amplificato e propagato dall’IFN α/β, INF-γ e INF-λ.
Queste citochine solubili inducono uno stato antivirale e antiproliferativo che inibiscono la replicazione virale e stimolano meccanismi di risposta immunitaria innati e adattativi.
Questa potente difesa antivirale sistemica esercita una pressione selettiva continua: infatti la maggior parte dei virus patogeni ha sviluppato meccanismi di evasione dell’azione degli interferoni.
Mentre INF-γ si lega ad un recettore di tipo II, l’IFNα e β si legano ad una proteina di tipo I composta da due subunità: il recettore dell’interferone di tipo 1 (IFNAR1) e di tipo 2 (IFNAR2) (vedi figura).
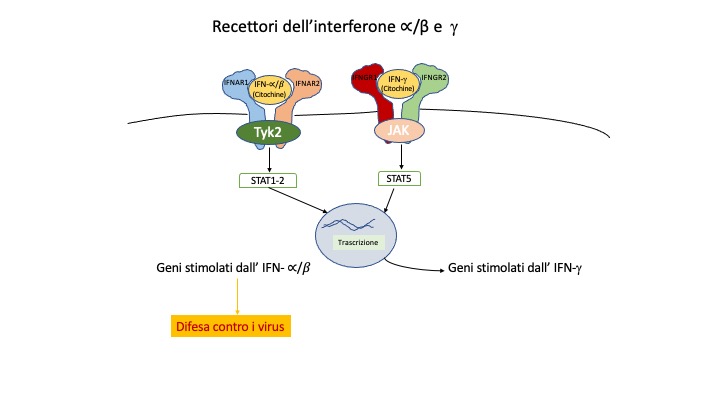
La connessione tra HLH e Recettore dell’interferone di tipo I
Recentemente, sono stati descritti pazienti affetti da HLH che presentano mutazioni nei geni IFNAR1, STAT1 e STAT2 inattivanti la funzionalità del recettore.
La HLH che si osserva in questi pazienti si sviluppa in seguito all’inoculazione di vaccini con virus vivi attenuati o a infezioni da virus.
Mutazioni in IFNAR2 che risultano in un deficit funzionale sono molto rari: in letteratura è stato descritto un solo paziente affetto da HLH causata da mutazioni in INFNAR2 (1).
Fino ad oggi.
Il gruppo della Dr.ssa Prencipe, dell’Ospedale Bambino Gesù di Roma, che già conosciamo per aver partecipato al 1^ bando per il miglior articolo scientifico intitolato a Mario Ricciardi, ha identificato un secondo bimbo, affetto da HLH e che presenta mutazioni nel recettore INFNAR2 (2).
Attraverso il sequenziamento esomico del DNA del bimbo e dei genitori, i ricercatori hanno identificato due mutazioni mai descritte prima, che producono una proteina di INFNAR2 più corta e non funzionante. Tramite saggi funzionali condotti in laboratorio i ricercatori hanno potuto stabilire che nel giovane paziente la risposta immunitaria ai virus mediata dall’IFNα era completamente assente, mentre quella mediata dall’INF-γ era intatta.
La conclusione dei ricercatori
Questi risultati suggeriscono una relazione tra HLH e risposta immunitarie difettosa dell’IFNα/β che al momento però rimane tutta da chiarire.
Un primo indizio che ha aiutato i ricercatori nella comprensione del meccanismo molecolare è il fatto che i difetti nella citotossicità delle cellule Natural Killer (NK) si verificano in pazienti con HLH primaria e secondaria (3).
La seconda indicazione sono stati i recenti risultati che dimostrano come l’IFNα possa indurre l’attività citotossica delle cellule NK attraverso il legame con il proprio recettore (4).
Questo spiega come l’incapacità dell’IFNα di suscitare una attivazione del recettore (perché non funzionante) possa innescare una risposta immunitaria ai virus insufficiente e indurre l’HLH.
I dati funzionali ottenuti dai ricercatori romani confermano proprio questa ipotesi, e cioè che la compromissione della risposta all’IFN α/β causa una degranulazione difettosa nelle cellule NK con la conseguente persistenza del virus e della risposta all’INF-γ responsabile dell’iper-infiammazione e quindi della HLH nel piccolo paziente esaminato.
Questa tesi deve trovare conferma in un più ampio gruppo di pazienti. Sicuramente potrebbe essere un campanello d’allarme in quegli episodi di HLH che si registrano dopo la somministrazione di un vaccino virale vivo attenuato: questi casi dovrebbero essere suggerire ai medici specialisti la presenza di un possibile difetto nella risposta all’IFN α/β e quindi meritevoli di una analisi medica più approfondita.
Bibliografia
- Duncan CJ, Mohamad SM, Young DF, et al. Human IFNAR2 deficiency: Lessons for antiviral immunity. Sci Transl Med. 2015;7(307):307ra154.
- Passarelli C, Civino A, Rossi MN, Cifaldi L, Lanari V, Moneta GM, Caiello I, Bracaglia C, Montinaro R, Novelli A, De Benedetti F, Prencipe G. IFNAR2 Deficiency Causing Dysregulation of NK Cell Functions and Presenting With Hemophagocytic Lymphohistiocytosis. Front Genet. 2020 Sep 18;11:937.
- Vandenhaute J, Wouters CH, Matthys P. Natural Killer Cells in Systemic Autoinflammatory Diseases: A Focus on Systemic Juvenile Idiopathic Arthritis and Macrophage Activation Syndrome. Front Immunol. 2020;10:3089
- Paolini R., Bernardini G., Molfetta R., Santoni A. (2015). NK cells and interferons. Cytokine Growth Factor Rev. 26 113–120.
