Le analogie dell’iperinfiammazione da HLH e COVID19
Negli ultimi due anni, molti termini medici riferiti alle malattie respiratorie quali infezioni virali, sindrome respiratoria acuta, immunità, sono entrati prepotentemente nel nostro vocabolario. Anche il termine iperinfiammazione, o tempesta di citochine è divenuta familiare proprio perché, già nei primi mesi della emergenza sanitaria, la comunità scientifica aveva osservato l’analogia tra l’iperinfiammazione causata da SARS-CoV-2 e quella rilevata nella HLH.
Anche AILE, in un precedente blog (giugno 2020), si è occupata di iperinfiammazione prendendo spunto dalla pubblicazione di Mehta et al., 2020 (1) e ne ha messo in luce somiglianze e differenze.
Ciò che accomuna l’iperinfiammazione nelle due patologie è il ruolo delle citochine. Le citochine sono piccole molecole glicoproteiche prodotte dai linfociti T con funzione di difesa immunitaria, che in situazioni particolari, come nell’infezione da SARS-CoV-2 e nella HLH sono in grado di super attivare monociti/macrofagi che a loro volta scatenano la tempesta. Quindi l’inibizione della produzione di citochine è diventata per il mondo scientifico un target terapeutico interessante.
Quali citochine bloccare?
La prima fondamentale domanda è: quali citochine bloccare?
Queste molecole sono numerose, di tipo diverso e tutte con una funzione importante nella difesa dell’organismo. Le funzioni pleiotropiche e parzialmente ridondanti associate alla maggior parte delle citochine possono rappresentare un problema per le strategie terapeutiche mirate a una singola citochina.
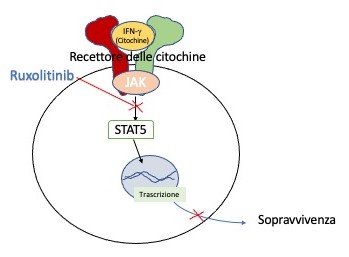
Un contributo importante nel rispondere a questa domanda viene dagli studi scientifici sulla HLH secondaria (sHLH). Studi precedenti avevano stabilito che l’interferone gamma (IFN-γ) è la citochina attivatrice principale dei monociti patologici e che il blocco di una molecola ad attività chinasica appartenente alla famiglia Janus (JAK) a valle del recettore poteva avere una applicazione clinica cruciale.
Studi sull’utilizzo del Ruxolitinib
La Prof.ssa Nichols ha effettuato delle ricerche prima nei topi e successivamente in un piccolo gruppo di pazienti. I risultati hanno dimostrato che l’inibizione della proteina JAK placava la tempesta di citochine (2). Ndr. L’articolo ha partecipato alla prima edizione del premio Mario Ricciardi.
L’inibitore utilizzato era il Ruxolitinib, un anticorpo sintetico che blocca il funzionamento del recettore su cui agisce IFN-γ e che ha prodotto significativi risultati nel migliorare sia i sintomi che la citopenia in pazienti adulti sHLH. Grazie a questi studi, il Ruxolitinib è stato approvato in studi clinici per pazienti con sintomi gravi di COVID-19 e la sperimentazione è già alla II/III fase.
Altri inibitori simili al Ruxolitinib sono stati sviluppati e sono in corso trial clinici per ridurre l’iperinfiammazione in malati da COVID-19 che potrebbero avere una rilevanza terapeutica anche per i pazienti HLH (3). L’approccio inibitorio della produzione di citochine scoperto nello studio della sHLH ha aiutato a trattare l’iperinfiammazione nell’infezione da COVID-19.
Il ruolo del Desametasone nella morte dei linfociti
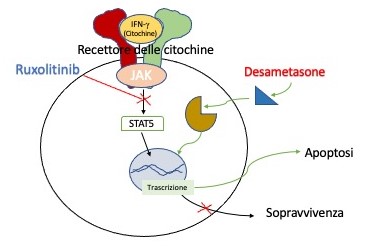
Un ulteriore passo avanti nella strategia terapeutica è stato fatto dal gruppo della Prof.ssa Nichols. La ricercatrice si è chiesta come mai i pazienti HLH talvolta non rispondono ai trattamenti con glucocorticoidi (esempio il desametasone) e l’etoposide, che dovrebbero indurre la morte (apoptosi) delle cellule immunitarie produttrici delle citochine e ridurre l’iperinfiammazione.
Utilizzando lo stesso modello murino usato nella prima sperimentazione, i ricercatori hanno scoperto che la resistenza alla morte dei linfociti indotta da Desametasone avviene attraverso l’attivazione di una molecola chiamata STAT5, a valle dell’attivazione dei recettori delle citochine. Il che significa che se si inibisce il recettore citochinico con il Ruxolitinib si dovrebbe ripristinare la capacità del Desametasone di indurre la morte dei linfociti T responsabili della tempesta citochinica.
In effetti così è stato: in un sistema di cellule di pazienti HLH coltivate in vitro ha dimostrato che il trattamento con Ruxolitinib rende le cellule sensibili al Desametasone che finalmente può indurre la morte delle cellule immunitarie che causano l’iperinfiammazione (4).
Un orizzonte da esplorare per HLH e COVID19.
Questo nuovo contributo scientifico non aiuta solo i malati di HLH ma anche quelli affetti da COVID 19.
Il SARS-CoV-2, ha ucciso più di 350 000 persone in tutto il mondo, molte delle quali hanno subito una tempesta citochinica.
L’Organizzazione Mondiale della Sanità sconsiglia l’uso di glucocorticoidi nel trattamento del COVID-19, ma negli studi clinici è attualmente possibile esplorare una varietà di approcci mirati alle citochine infiammatorie. Al momento, non è chiaro quale sia il miglior trattamento possibile per la iper-infiammazione da COVID-19, ma sono disponibili finalmente diverse opzioni, inclusi gli inibitori JAK/STAT come Ruxolitinib.
Tutta la comunità di pazienti HLH si augura che a breve si apra un nuovo trial clinico che permetta di valutare in modo scientifico l’impatto di questo duplice trattamento (Ruxolitinib+ Desametasone) nel controllo della tempesta di citochine nella HLH familiare e secondaria.
Bibliografia
- Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ; HLH Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020 Mar 28;395(10229):1033-1034
- Albeituni S, Verbist KC, Tedrick PE, Tillman H, Picarsic J, Bassett R, Nichols KE. Mechanisms of action of ruxolitinib in murine models of hemophagocytic lymphohistiocytosis. Blood. 2019 Jul 11;134(2):147-159. doi:
- Wilcox RA. Janus Family kinase (JAK) inhibitors in HLH and severe COVID-19. Am J Hematol. 2020 Dec;95(12):1448-1451.
- Meyer LK, Verbist KC, Albeituni S, Scull BP, Bassett RC, Stroh AN, Tillman H, Allen CE, Hermiston ML, Nichols KE. JAK/STAT pathway inhibition sensitizes CD8 T cells to dexamethasone-induced apoptosis in hyperinflammation. Blood. 2020 Aug 6;136(6):657-668. – 2a Classificata al Premio Mario Ricciardi
