L’importanza dei macrofagi e l’emofagocitosi
La plasticità funzionale dei macrofagi nel rispondere agli stimoli infiammatori è centrale nella risposta immunitaria. I macrofagi rappresentano una popolazione cellulare estremamente eterogenea che origina nel midollo spinale e che si localizza strategicamente in diversi organi e tessuti per processare materiale estraneo al nostro corpo o cellule morte che hanno terminato la loro funzione.
Si possono identificare diverse sottopopolazioni di macrofagi deputate a specifiche funzioni (1).
I macrofagi infatti possono:
a) fagocitare patogeni, detriti cellulari e cellule morte;
b) presentare l’antigene ai linfociti in associazione con le molecole del complesso maggiore di istocompatibilità (MHC-I and MHC-II);
c) produrre differenti tipi di citochine per attivare o sopprimere la riposta immunitaria di tipo adattativo (2).
Ma come fanno i macrofagi a distinguere chi fagocitare?
Ovvero, quali segnali distinguono il materiale cellulare morto da quello vivo, in modo che un macrofago non elimini una cellula sana funzionante? Esiste un segnale “‘don’t eat-me’ (non mangiatemi) che impedisce ad una cellula di essere erroneamente eliminata. Questo segnale si attiva quando il recettore transmembrana chiamato CD47 (espresso dai globuli rossi, leucociti, piastrine e cellule sane) si lega al recettore SIRPα presente sui macrofagi, che disattiva conseguentemente il meccanismo di eliminazione della cellula. Pertanto, la fagocitosi si attiva solamente quando si verifica la rottura del legame tra i recettori CD47- SIRPα consentendo cosi l’eliminazione della cellula target.
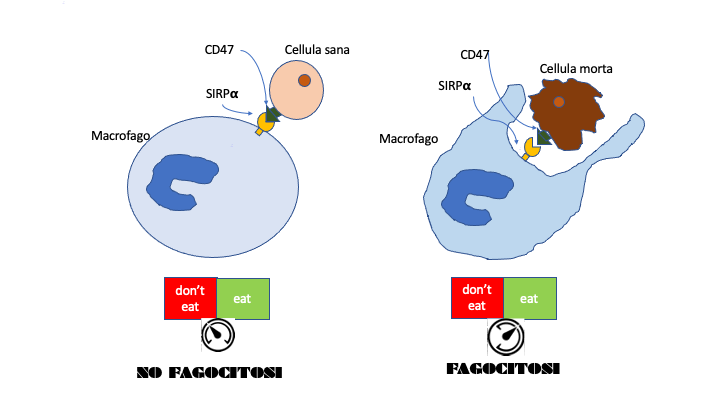
Emofagocitosi e HLH
Durante le manifestazioni cliniche, in particolare nelle HLH secondarie (sHLH), si osserva l’iperattivazione dei macrofagi che “inghiottono” cellule sane della linea ematopoietica come globuli rossi e bianchi, piastrine ecc, riducendone il numero in modo significativo nel sangue periferico. Questo fenomeno, chiamato emofagocitosi, è attribuito alla presenza di elevate concentrazioni di citochine.
Ma in che modo i segnali iper-infiammatori delle citochine possano indurre una iper-stimolazione dei macrofagi e altre cellule al punto da innescare la emofagocitosi cioè la eliminazione di cellule sane?
Questo è rimasto inspiegato fino alla pubblicazione nel 2019 e nel 2020 di due articoli chiarificatori. Il primo lavoro, pubblicato nella prestigiosa rivista PNAS (3), ha dimostrato che i macrofagi eliminano cellule sane, quando si verificano contemporaneamente due condizioni: a) la rottura dell’asse SIRPα-CD47, b) la presenza di segnali attivatori di tipo pro-infiammatori come per esempio le citochine IL-1β, IL-6, TNFα o IL-17α.
Il secondo articolo intitolato: Inflammation Unrestrained by SIRPα Induces Secondary Hemophagocytic Lymphohistiocytosis Independent of IFN-γ (4), utilizzando dei modelli animali knock out (ko), ha chiarito le differenti funzioni di SIRPα e CD47 nell’emofagocitosi in condizioni infiammatorie.
Come dimostrato nel topo ko l’assenza del recettore SIRPα consente a vari stimoli pro-infiammatori di sviluppare sHLH nei topi ko. SIRPα è quindi il freno che impedisce l’attivazione dell’emofagocitosi nelle cellule mieloidi (tra cui i macrofagi) e contrasta l’iper-attivazione cellulare prodotta dalle citochine. Al contrario CD47, blocca solo l’emofagocitosi, l’anemia e splenomegalia ma non induce sHLH. Le citochine pro-infiammatorie come IL-1β, IL-6, TNFα o IL-17A, ma non IFNγ, funzionano da segnali attivatori dell’emofagocitosi. Questo risultato è piuttosto sorprendente in quanto IFNγ è cruciale nel processo infiammatorio e si considera strettamente associato alla sHLH.
Il ruolo del IFNγ come presunto segnale attivante dell’emofagocitosi nei macrofagi rimane quindi da approfondire. In aggiunta, rimane da esaminare se prima dell’insorgenza della sHLH si verificano degli eventi che determinano la riduzione dell’espressione o la perdita del recettore SIRPα. Alcuni studi, infatti, hanno dimostrato che particolari condizioni infiammatorie o patologiche come la nefropatia diabetica sono associate a una perdita dell’espressione di SIRPα (3).
Il ruolo cruciale nelle strategie terapeutiche
Il ruolo cruciale di queste due proteine le mette al centro di possibili strategie terapeutiche soprattutto nel campo oncologico dove le cellule tumorali esprimono gli stessi livelli di CD47 delle cellule sane.
Tre meccanismi vengono già utilizzati nella clinica oncologica per inibire l’interazione CD47/SIRPα e favorire quindi la rimozione delle cellule cancerose:
1) bloccare l’interazione CD47/SIRPα e promuovere la fagocitosi delle cellule tumorali;
2) promuovere la presentazione dell’antigene attraverso l’anticorpo antiCD47 che permette di collegare le cellule tumorali e le cellule dendritiche SIRPα positive per promuovere la presentazione dell’antigene;
3) indurre la apoptosi delle cellule tumorali attraverso l’uso di alcuni anticorpi specifici antiCD47 (5,6).
E nell’sHLH?
Per quanto riguarda la sHLH, dove l’espressione di SIRPα in condizioni infiammatorie potrebbe essere variabile, le strategie terapeutiche mediante l’uso di alcuni anticorpi specifici rimangono una sfida. Una biotech americana che sviluppa terapie anticorpali contro le proteine SIRP, è in procinto di testare un nuovo prodotto in un trial clinico di fase 1 per la sHLH. Il nuovo anticorpo mira a rimuovere dalla circolazione sanguigna le cellule mieloidi e cellule T patologiche iper-attivate in modo da inibire la tempesta citochinica e controllare il decorso della malattia. Questo trial sarà prezioso perché aumenterà la nostra comprensione sulla natura e sulla forza relativa dei segnali di attivazione e di inibizione mediato da SIRPα e potrà dare risposte terapeutiche ad una sindrome che ha ancora una mortalità elevata stimata del 60 percento degli adulti entro quattro anni dall’insorgenza della malattia.
Bibliografia
1. Gordon S, Taylor PR. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 2005 Dec;5(12):953-64.
2. Labonte AC, Trampont ACT, Hahn YS. The Role of Macrophage Polarization in Infectious and Inflammatory Diseases. Mol. Cells 2014;37:275-285
3. Wang A, Pope SD, Weinstein JS, Yu S, Zhang C, Booth CJ, Medzhitov R. Specific sequences of infectious challenge lead to secondary hemophagocytic lymphohistiocytosis-like disease in mice. Proc Natl Acad Sci U S A. 2019 Feb 5;116(6):2200-2209
4. Kidder K, Bian Z, Shi L, Liu Y. Inflammation Unrestrained by SIRPα Induces Secondary Hemophagocytic Lymphohistiocytosis Independent of IFN-γ. J Immunol. 2020 Nov 15;205(10):2821-2833
5. Qu T, Li B, Wang Y. Targeting CD47/SIRPα as a therapeutic strategy, where we are and where we are headed. Biomark Res. 2022 Apr 13;10(1):20.
6. Bian Z, Shi L, Guo Y-L, Lv Z, Tang C, Niu S, Tremblay A, Venkataramani M, Culpepper C, Li L, Zhou Z, Mansour A, Zhang Y, Gewirtz A, Kidder K, Zen K, and Liu Y. 2016 Cd47-Sirpα interaction and IL-10 constrain inflammation-induced macrophage phagocytosis of healthy self- cells. Proceedings of the National Academy of Sciences 113: E5434-E5443.
