Premio Mario Ricciardi

L’Associazione AILE Onlus bandisce 2 premi per il Migliore Articolo Scientifico, su tematiche concernenti la Linfoistiocitosi Emofagocitica, in memoria di Mario Ricciardi. A questo scopo, è indetta una procedura selettiva per l’attribuzione dei premi per due articoli scientifici pubblicati nel biennio 2018-2019. Si è dimostrato un evento molto partecipato e di alto profilo scientifico la prima edizione del premio. Un ringraziamento ai giovani ricercatori che hanno partecipato al bando per il loro prezioso contributo.
A.I.L.E. Association announces 2 awards for the Best Scientific Article, on issues concerning Hemophagocytic Lymphohistiocytosis (HLH), in memory of Mario Ricciardi.
A selective procedure for award two scientific articles published during the 2018-2019 is announced.
The first edition of the award to the memory of Mario Ricciardi proved to be a partecipated and higly scientific event.
We want to tank all the young researchers who participated in the call.
VINCITORI
1° Classificato Dr. Canna Scott
Assistant Professor, Pediatric Rheumatology, University of Pittsburgh School of Medicine, Pittsburg, United States.
Weiss ES, Girard-Guyonvarc’h C, Holzinger D, de Jesus AA, Tariq Z, Picarsic J, Schiffrin EJ, Foell D, Grom AA, Ammann S, Ehl S, Hoshino T, Goldbach-Mansky R, Gabay C, Canna SW.
Interleukin-18 diagnostically distinguishes and pathogenically promotes human and murine macrophage activation syndrome. Blood. 2018 Mar 29;131(13):1442-1455.
Il mio gruppo, composto da medici e scienziati, vuole conoscere quali sono le cause dell’HLH, in modo da poter trattare meglio i pazienti. Difetti nell’eliminazione di cellule infette contribuiscono in modo determinante alla HLH, ma non rappresentano l’intera storia di ogni paziente HLH. Questo articolo è stato costruito sulla nostra precedente scoperta che le mutazioni nell’inflammasoma* NLRC4 causano iperinfiammazione e una concentrazione di IL-18 cronicamente elevata senza influire sulla capacità di eliminare cellule infette. Abbiamo prima esaminato pazienti affetti da forme inedite di HLH e da malattie infiammatorie e abbiamo scoperto che livelli molto elevati di IL-18 erano specifici per la sindrome da attivazione dei macrofagi (MAS), una forma di HLH osservata nelle malattie reumatiche. Inoltre, abbiamo scoperto che, come negli esseri umani mutazioni nell’inflammasoma NLRC4-MAS prodotte in topi da laboratorio, risultano in un incremento dell’IL-18 spontaneo a partire dalla nascita. Sorprendentemente, questo IL-18 deriva dalle cellule intestinali degli animali. Usando un sistema diverso, abbiamo dimostrato che il solo incremento dell’IL-18 era ben tollerato, ma quando combinato con un innesco infiammatorio, portava ad una grave iperinfiammazione. Questi esperimenti contribuiscono a posizionare l’IL-18 a monte della MAS come una nuova causa di iperinfiammazione potenzialmente letale ma bersaglio di possibili terapie.
NdR: *Gli inflammasomi sono complessi di svariate proteine che si trovano disperse nel citoplasma di molte cellule del sistema immunitario innato e che sono responsabili dell’attivazione delle risposte infiammatorie.
As physicians and scientists, my group wants to know what causes HLH, so we can better treat patients. Defects in cell killing are important contributors to HLH, but they are not the whole story for every HLH patient. This manuscript builds on our previous discovery that mutations in the NLRC4 inflammasome cause hyperinflammation and chronically elevated IL-18 without affecting cell killing. We first looked at an unprecedented variety of HLH and inflammatory disease patients, and found that very high IL-18 levels were specific for Macrophage Activation Syndrome (MAS), a form of HLH seen in rheumatic diseases. Further, we found that, like NLRC4-MAS humans, mice with an NLRC4 mutation made excess IL-18 spontaneously starting at birth. Surprisingly, this IL-18 was derived from the animals’ intestinal cells. Using a different system, we demonstrated that IL-18 on its own was well-tolerated, but when combined with an inflammatory trigger, led to severe hyperinflammation. These experiments helped place IL-18 upstream of MAS as a new and targetable cause of life-threatening hyperinflammation.
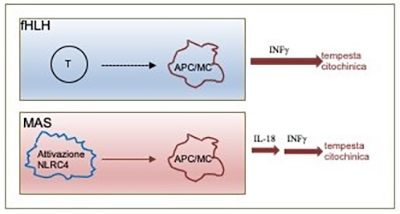
Questo articolo ha dimostrato la capacità dell’interleuchina-18 (IL-18) circolante nel plasma di distinguere la sindrome da attivazione dei macrofagi (MAS) da altri disturbi infiammatori come fHLH e HLH secondaria. Inoltre, che IL-18 non è solo un biomarcatore ma piuttosto un fattore di infiammazione e potenziale bersaglio terapeutico in pazienti con MAS.

2° Classificato Dr Chinn Ivan
Director, Immunogenetics Program, Texas Medical Center – Houston, United States
Chinn IK, Eckstein OS, Peckham-Gregory EC, Goldberg BR, Forbes LR, Nicholas SK, Mace EM, Vogel TP, Abhyankar HA, Diaz MI, Heslop HE, Krance RA, Martinez CA, Nguyen TC, Bashir DA, Goldman JR, Stray-Pedersen A, Pedroza LA, Poli MC, Aldave-Becerra JC, McGhee SA, Al-Herz W, Chamdin A, Coban-Akdemir ZH, Jhangiani SN, Muzny DM, Cao TN, Hong DN, Gibbs RA, Lupski JR, Orange JS, McClain KL, Allen CE. Genetic and mechanistic diversity in pediatric hemophagocytic lymphohistiocytosis. Blood. 2018 Jul 5;132(1):89-100.
Il nostro studio evidenzia la potenziale utilità clinica di test genetici ampi per bambini con sintomi di infiammazione patologica. Abbiamo studiato 122 bambini etnicamente eterogenei che soddisfacevano i criteri HLH-2004. Dei 101 che sono stati sottoposti a test genetici, quasi la metà aveva avuto probabili spiegazioni genetiche per HLH, e tutti coloro che hanno avuto l’insorgenza della malattia prima di 1 anno di età, hanno presentato una diagnosi molecolare. Il sequenziamento dell’intero esoma a livello di ricerca di 48 bambini ha rivelato che l’eziologia genetica (per il 58% dei casi) non includeva semplicemente i geni HLH familiari tradizionali. Piuttosto, abbiamo scoperto una serie di meccanismi fisiopatologici che portano alla disfunzione immunitaria, comprese le malattie da immuno-deficienza primarie sottostanti e l’attivazione immunitaria disregolata o la proliferazione. Queste diagnosi alternative possono essere acquisite solo tramite test di laboratorio e genetici ampliati. Criticamente, alcune di queste condizioni possono essere trattate con interventi mirati, mentre altre richiedono il trapianto di cellule staminali ematopoietiche. In questo articolo abbiamo quindi dimostrato che la diagnosi di “HLH” identifica bambini con disregolazione immunitaria che è il punto finale comune di molte altre possibili malattie.
Our study highlights the potential clinical utility of broad genetic testing for children with symptoms of pathologic inflammation. We investigated 122 ethnically heterogenous children who fulfilled the HLH- 2004 criteria. Of the 101 who underwent genetic testing, nearly half had likely genetic explanations for HLH, and all who had disease onset before 1 year of age carried a molecular diagnosis. Research-level whole exome sequencing of 48 children revealed that genetic etiologies (for 58% of cases) did not merely encompass the traditional familial HLH genes. Rather, we uncovered a range of pathophysiological mechanisms leading to immune dysfunction, including underlying primary immunodeficiency diseases and dysregulated immune activation or proliferation. These alternate diagnoses can only be captured by expanded laboratory and genetic testing. Critically, some of these conditions can be treated with targeted interventions, while others require hematopoietic stem cell transplantation. We therefore demonstrate that diagnosis of “HLH” identifies children with immune dysregulation as a common endpoint from multiple potential etiologies.
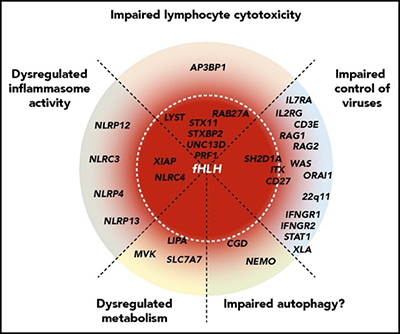
Questo articolo riporta i risultati genetici in un gruppo numeroso di bambini con HLH, e indica che molti casi possono essere spiegati da mutazioni di geni diversi da quelli richiesti per la citotossicità dei linfociti quali PRF1,UNC13D,STX11,STXBP2,RAB27A, e LYST ma che portano alla disfunzione immunitaria della “HLH”
