Abbiamo descritto in più occasioni quali sono i meccanismi molecolari che conducono alla HLH familiare (fHLH). Oggi riprendiamo l’argomento perché un team internazionale di scienziati in Finlandia, Norvegia, Svezia e Austria hanno scoperto un nuovo meccanismo che ha come oggetto la proteina RhoG (1). Ma partiamo dall’inizio. Sappiamo che la fHLH è causata da alterazioni in diversi geni necessari per il corretto funzionamento, movimento e rilascio di granuli citotolitici (GC) da parte delle cellule T e delle cellule Natural Killer (NK). Queste varianti geniche determinano l’incapacità dei linfociti T e delle NK, di uccidere una cellula bersaglio infetta (ad esempio, infetta da virus). Di conseguenza, il corpo umano secerne messaggeri biologici, le cosiddette “citochine”, che generano una massiccia attivazione immunitaria e conseguentemente una iper-infiammazione che può condurre alla morte in breve tempo.
RhoG regola la citotossicità dei linfociti
La storia di questa nuova scoperta è iniziata con un paziente finlandese, un bambino che aveva sviluppato una HLH grave all’età di quattro mesi e per il quale non erano state trovate mutazioni nei geni causativi dell’HLH, sebbene la malattia rilevata nel piccolo paziente fosse associata a una ridotta capacità citotossica delle cellule T e NK. Ulteriori analisi genetiche tramite il sequenziamento dell’esoma, (ndr: la parte genica attiva del genoma umano) hanno rivelato delle alterazioni geniche deleterie nel gene che produce la proteina RhoG. Successive analisi biochimiche e funzionali dei linfociti del bambino T e NK hanno dimostrato che l’assenza di RhoG influenza la migrazione cellulare, la formazione di sinapsi immunitarie (SI) e il rilascio di GC e quindi la rimozione delle cellule infette.
RhoG, la super proteina
RhoG è un piccolo enzima che libera energia dalla scissione del GTP, una molecola ubiquitaria nell’ organismo umano. Attraverso la sua attività enzimatica è in grado di regolare processi biologici chiave, tra cui la proliferazione cellulare, la dinamica del citoscheletro (ndr, l’impalcatura che permette alle cellule di avere una forma) e il traffico delle vescicole (2). Sebbene sia noto che RhoG è importante per la dinamica del citoscheletro di microtubuli e actina in vari tipi di cellule, Kalinichenko et al (1) hanno scoperto un nuovo ruolo di RhoG nella modulazione del citoscheletro durante il rilascio dei GC nei linfociti T e NK.
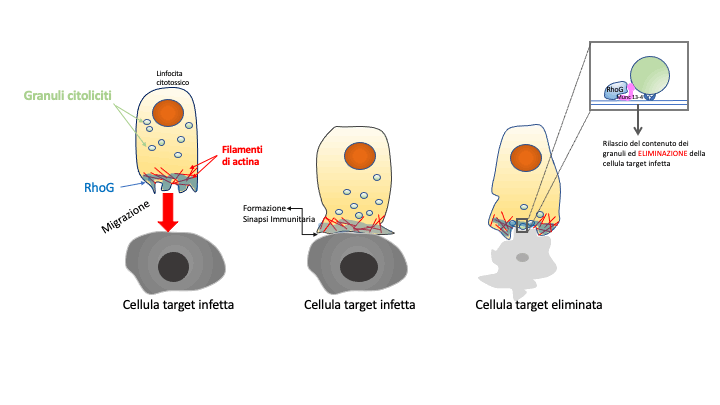
Il meccanismo è il seguente (vedi figura): dopo l’attivazione, i linfociti T polarizzano e migrano verso la cellula bersaglio tramite la polimerizzazione dell’actina sul bordo anteriore della cellula, dove si concentra RhoG. I linfociti T entrano quindi in contatto con le cellule bersaglio, dove formano un SI stabile guidata dall’accumulo di actina e RhoG. Nel frattempo i GC, presenti nel citoplasma dei linfociti T, vengono traportati nella SI dove l’actina, depositata in precedenza, viene rimossa dall’azione combinata di RhoG e una seconda proteina chiamata MUNC13-4 per permettere a ciascun granulo di agganciarsi e di riversare il contenuto citotossico nella cellula target, permettendo la sua eliminazione. Le mutazioni deleterie nel gene che produce RhoG, trovate nel bimbo finlandese impediscono che questa proteina svolga il suo ruolo, precludendo così il corretto rilascio dei GC e di fatto permettendo la sopravvivenza delle cellule infette che sono la causa del processo a cascata che porta alla iper-infiammazione caratteristica della fHLH.
Un processo diagnostico più accurato per i pazienti
La comprensione di questo nuovo meccanismo molecolare dell’HLH familiare, permette ora ai ricercatori di effettuare diagnosi genetiche migliorate e ottenere dati per potenziare lo sviluppo di trattamenti terapeutici mirati. Vorrei chiudere questo report citando le parole del Prof. Saarela, Direttore del Centro di Medicina Molecolare Norvegia, nonché direttore del gruppo finlandese che ha partecipato al lavoro scientifico. “Le strette connessioni tra diagnostica clinica e ricerca aiutano a definire la diagnosi molecolare per i pazienti affetti da malattie rare che soffrono di disturbi non ancora identificati. Fornisce inoltre l’opportunità di scoprire nuovi geni della malattia e di comprendere i loro meccanismi patogenetici, che possono avere un impatto sulla gestione e sulla prognosi della malattia”.
AILE, in sintonia con questa visione, sostiene da anni la ricerca scientifica perché l’HLH diventi presto una malattia facilmente diagnosticabile e curabile.
Fonti
- Kalinichenko A, Perinetti Casoni G, Dupré L, et al. RhoG deficiency abrogates cytotoxicity of human lymphocytes and causes hemophagocytic lymphohistiocytosis. Blood. 2021;137(15):2033-2045.
- Mosaddeghzadeh N, Ahmadian MR. The RHO Family GTPases: Mechanisms of Regulation and Signaling. Cells. 2021 Jul 20;10(7):1831.
Leggi anche
Un nuovo approccio all’analisi di varianti germinali predice le conseguenze funzionali di mutazioni di significato incerto
Come si effettua l'identificazione delle varianti germinali Una delle sfide nella HLH familiare (fHLH) è sicuramente quella di giungere ad una rapida ed accurata diagnosi. Nei pazienti affetti da...
La ATCT: il trapianto di cellule T come terapia nella HLH
Prima di parlare dell'ATCT bisogna chiarire a cosa servono le cellule T e che ruolo hanno nella Linfoistiocitosi Emofagocitica. Le cellule T, anche dette CTL. Le cellule T sono i linfociti T...
Una proposta per migliorare la diagnosi e la terapia della HLH/MAS dagli Stati Uniti
Quali sono i modelli e gli approcci e come migliorare la terapia per l'HLH? Confermare una diagnosi di Linfoistiocitosi Emofagocitica (HLH) può essere difficile per diversi motivi: la rarità della...
Anakinra è efficace nel trattamento delle HLH secondarie?
Prima di Anakinra... con la ricerca sull'HLH a che punto siamo? La nostra comprensione della HLH è sicuramente progredita negli ultimi 20 anni, favorendo lo sviluppo diagnostico e terapeutico....
Caregivers: i bisogni inascoltati di coloro che assistono i malati
Chi sono i caregivers? Una recente pubblicazione scientifica riguardante i caregivers, termine inglese che indica “coloro che si prendono cura dei malati” ha catturato la mia attenzione sia perché...
Scoperto un nuovo gene coinvolto nella manifestazione clinica della HLH familiare: NBAS
Gli sforzi nell'identificare i geni associati all'HLH Nell’ultimo ventennio lo sforzo dei ricercatori nell’identificare geni associati alla sindrome dell’HLH è cresciuto esponenzialmente. Grazie a...
Terapie CAR-T e possibili complicazioni – una manifestazione clinica di HLH
Che cosa sono le terapie CAR-T? Nel 2019 l’AIFA, l’agenzia Italiana per il farmaco, ha autorizzato una nuova terapia in pazienti affetti da una particolare forma di leucemia quella linfoblastica...
Uno studio cinese delinea le cause della HLH secondaria
La Linfoistiocitosi Emofagocita secondaria (sHLH) è diagnosticataprincipalmente negli adulti in seguito a cause non del tutto identificate come tumori, infezioni o malattie autoimmuni. Sebbene...
Emofagocitosi nella HLH: un puzzle non ancora completo
L'importanza dei macrofagi e l'emofagocitosi La plasticità funzionale dei macrofagi nel rispondere agli stimoli infiammatori è centrale nella risposta immunitaria. I macrofagi rappresentano una...
Predisposizione genetica alla HLH: a che punto siamo?
La predisposizione genetica La predisposizione o suscettibilità genetica, indica una serie di caratteristiche genetiche che rendono possibile il manifestarsi di una malattia. L’analisi delle...
Gene editing: terapia promettente per l’HLH?
Che cos'è la gene editing? Può essere una possibile terapia per le malattie istiocitarie come l'HLH? Ce ne parla la Dott.ssa Fortunati in questo interessante articolo. La terapia genica nello studio...
Diagnosticare l’HLH secondaria sarà più facile grazie a un test del sangue: i risultati dei ricercatori finanziati da AILE
Nuove e fondamentali evidenze scientifiche sulla HLH Al Bambino Gesù di Roma hanno scoperto una sottopopolazione di linfociti T nel sangue la cui presenza consente di diagnosticare l'HLH secondaria...
L’HLH si manifesta sempre con un’infezione?
L’HLH è una sindrome iperinfiammatoria provocata da una incontrollata attivazione del sistema immunitario. Ma che cosa provoca la sua comparsa? È sempre un'infezione a far manifestare l'HLH?Sappiamo...
Incidenza dell’HLH: un nuovo studio epidemiologico inglese mostra un incremento
L'incidenza dell'HLH Uno dei maggiori problemi riguardanti la Linfoistiocitosi Emofagocitica è proprio quello di quantificare l’incidenza dell'HLH. Come tutti sanno l’incidenza è una relazione...
La relazione tra l’interferone alpha/beta e gamma rimane elusiva nella HLH
Il ruolo dell'interferone nella risposta immunitaria Nell’ultimo blog abbiamo parlato delle soluzioni terapeutiche emergenti per il controllo dell’iper-infiammazione nella HLH e abbiamo visto come...
L’uso di Anticorpi sintetici per il controllo dell’iperinfiammazione mediata da interferone gamma nell’HLH e nel COVID19
Le analogie dell'iperinfiammazione da HLH e COVID19 Negli ultimi due anni, molti termini medici riferiti alle malattie respiratorie quali infezioni virali, sindrome respiratoria acuta, immunità,...
Scoperto un nuovo sottotipo genetico che causa l’HLH: la proteina RhoG regola l’attivazione dei linfociti T e NK
Abbiamo descritto in più occasioni quali sono i meccanismi molecolari che conducono alla HLH familiare (fHLH). Oggi riprendiamo l’argomento perché un team internazionale di scienziati in Finlandia,...
HLH e Sepsi: un nuovo articolo mette in luce l’importanza delle cellule T (CD8+)
Malatirari L'attenzione per questa patologia In un blog dell’anno scorso ci siamo occupati della HLH e delle somiglianze e /o differenze con la Sepsi (blog febbraio 2020). Perché questa attenzione...
L’impatto psicologico e sociale della HLH primaria valutata da pazienti e dai loro familiari.
Malatirari Negli ultimi anni la ricerca medica, sta ponendo l'attenzione anche sugli aspetti sociali dei trattamenti e sull'impatto che questi hanno sulle famiglie. Questo tipo di ricerca medica è...
Informazioni utili sui vaccini per il Covid-19
FAQ VACCINI COVID-19: Risposte sul tema attraverso siti web delle organizzazioni internazionaliL’AILE tra le sue priorità ha la salute e la sicurezza dei suoi associati.Monitoriamo gli sviluppi...
I disturbi neurologici nell’HLH: una vera e propria sfida diagnostica.
Malatirari Disturbi neurologici hlh Le manifestazioni cliniche dell'HLH Le manifestazioni cliniche della HLH sono molte e a carico di diversi organi. Le sintomatologie principali sono le...
Progressi nella terapia genica dell’HLH
Malatirari La Linfoistiocitosi Emofagocitica La Linfoistiocitosi Emofagocitica (HLH) ereditaria è causata da mutazioni in geni diversi che controllano la secrezione di granuli citotossici dalle...
Emapalumab nell’HLH ricorrente e progressiva
Malatirari Emapalumab è il primo farmaco approvato negli Stati Uniti per il trattamento della Linfoistiocitosi Emofagocitica o HLH, una malattia rara, iperinfiammatoria e pericolosa per la...
HLH negli adulti: le raccomandazioni per riconoscere la Linfoistiocitosi Emofagocitica
L'importanza della tempestività La Linfoistiocitosi Emofagocitica (HLH) negli adulti può colpire tutte le fasce di età e viene ormai riconosciuta in molti casi come malattia del sistema immunitario....
Ostruzione sinusoidale: una complicanza post-trapianto ad alta letalità
Cos'è l'ostruzione sinusoidale? Come sappiamo, il trapianto di cellule staminali ematopoietiche (HSCT) rappresenta il trattamento di scelta in alcune patologie ematologiche. In questo trattamento il...
Le cellule “Natural Killer” nella HLH secondaria diventano incapaci di produrre INFγ
La storia drammatica di Manuel, una giovane promessa dell’archeologia, che si è ammalato di HLH dopo il trapianto di cellule ematopoietiche (HSCT), illustra molto bene che cos’è questa fo...
HLH negli adulti dopo il trapianto: una realtà che inganna
La storia drammatica di Manuel, una giovane promessa dell’archeologia, che si è ammalato di HLH dopo il trapianto di cellule ematopoietiche (HSCT), illustra molto bene che cos’è questa fo...
La tempesta citochinica e l’immunosoppressione in HLH e nell’infezione da COVID-19
La prestigiosa rivista medica “Lancet” ha recentemente pubblicato un articolo di Mehta et al. intitolato “COVID-19: si consideri le sindromi da tempesta citochiniche e l’immunosoppressi...
Simili ma non le stesse: diagnosi differenziale di HLH e Sepsi
HLH e Sepsi sono due patologie simili ma non identiche. Distinguerle è molto importante perché permette un intervento terapeutico precoce e mirato essenziale per la sopravvivenza dei malati. Cos’è...
La sindrome linfoproliferativa di tipo 2 associata al cromosoma X (XLP-2)
Da qualche tempo alcuni test basati sulla citometria di flusso sono all’attenzione dei ricercatori per la loro capacità di diagnosticare in maniera accurata e precocemente la HLH.
...“Via al flusso: il nuovo test per la diagnosi della HLH”
Da qualche tempo alcuni test basati sulla citometria di flusso sono all’attenzione dei ricercatori per la loro capacità di diagnosticare in maniera accurata e precocemente la HLH.
...La sorprendente variabilità geografica del gene della Perforina
In una conversazione sulla HLH, il presidente di AILE mi espresse un giorno due curiosità
...Il trapianto di cellule staminali ematopoietiche spegne il fuoco dell’HLH
In un recente articolo pubblicato nel 2018 dalla rivista Biol. Blood Marrow Transplant, sono emersi aspetti fondamentali del trapianto allogenico di cellule staminali ematopoietiche (HSCT), in pa...
Trapianto del midollo in pazienti asintomatici con HLH
Una domanda cruciale per tutti coloro che sono coinvolti nella HLH è: Cosa fare, quando in un bambino che sta bene si identificano mutazioni che causano la linfoistiocitosi emofagocitica?
...